サツマイモ基腐病検出キットの使い方
サツマイモ基腐病検出キットの使い方

昨今のサツマイモ基腐病の深刻な広がりにより、ニッポンジーン マテリアルより販売しているDryADD™サツマイモ基腐病検出LAMPキットについてのお問い合わせをいただく機会も増えてまいりました。そこで、キットの使用感をよりイメージしていただきやすいよう、写真などを交えつつ検査手順をご説明いたします。
-
- 必ずキット付属の製品マニュアル【pdf】をよく読み、そちらに従って実施してください(本記事は製品マニュアルの補足としてご覧ください)。
- 記事の内容は2021年5月現在のものです。改良のため、製品仕様は予告なく変更される場合がございますので、あらかじめご了承ください。
- 「-LAMP法乾燥試薬- サツマイモ基腐病検出キット」から品名が変更となりました。製品内容に変更はございません。
1. 準備
まずはキット内容の確認です。キットには以下の①から⑤の試薬と製品説明書が入っています。
① Pd検出用乾燥試薬
② Pd試薬溶解液(試薬溶解液)
③ Pd陽性コントロール
④ Pd陽性コントロール溶解液
⑤ ミネラルオイル
吸湿を避けるために、①と③は乾燥剤入りのアルミパックに入っています。

図1:キットの外観(左)と、その中のキット構成品。
キットの確認が終わったら、準備が必要なものについて、事前に確認しておきましょう。
□氷冷する準備(冷やしたアルミラック、氷上に設置したプレートラックなど)はできていますか?
□65℃、40分保温できる環境(LAMP反応によるDNA増幅)はありますか?
□80℃、2分保温できる環境(反応停止)はありますか?
□DNA簡易抽出試薬(0.5 N NaOHと100 mM Tris-HCl (pH 8.0))は用意できていますか?
□検体分の清潔なペッスルとカミソリはありますか?
必要な器具の例
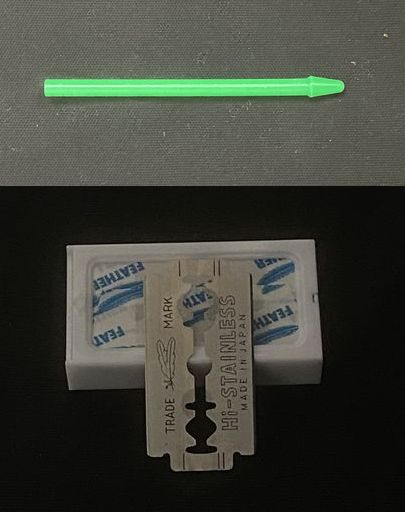
図2:ペッスル(上)とカミソリ(下)は検体分の用意が必要。 |

図3:マイクロピペット。使い慣れていない方は、こちらの記事も御覧ください |

図4:UV照射装置(携帯型)。検査したチューブすべてにUVを照射する場合は、UVトランスイルミネーターが便利。 |

図5:チューブラック。1.5 mLチューブ用とPCRチューブ用の2種類があると良い。 |
2. DNA抽出(工程A)
A-1. 以下のチューブを準備します。
① 0.5 N NaOH 150 μL が入った1.5 mLチューブ:検体と同数
② 100 mM Tris-HCl (pH 8.0) 150 μL が入った 1.5 mLチューブ:検体数+追加1本
※追加した100 mM Tris-HCl (pH 8.0) は「Pd陰性コントロール溶液」とします。
*製品マニュアルより引用
0.5 N NaOHと100 mM Tris-HCl (pH 8.0) はキットには付属しておりませんので、ご自身で準備していただく必要がございます。
ご参考までに、一例をお示しいたします。
*富士フィルム 和光純薬株式会社様の製品情報ページにジャンプします
調製例:
①0.5 N NaOH
→0.5mol/L 水酸化ナトリウム溶液をそのまま使用
②100 mM Tris-HCl (pH 8.0)
→1 M トリス-HCl (pH8.0)を、蒸留水で100 mMに希釈して使用
1 M Tris-HCl (pH 8.0) 100 µL
蒸留水 900 µL
Total 1,000 µL
*Tris-HCl (pH 8.0)にEDTAなどのキレート剤が入っているものは使用しないでください。キレート剤は本キットの蛍光発色に影響を与えるため、正しい結果が得られなくなります。
それぞれ検体分だけマイクロチューブに分注し、あらかじめ油性ペンなどで検体番号を記入しておきましょう。

図6:事前に準備しておくチューブ(6検体検査を行う場合)。この後の工程において、①は検体を磨砕するときに用い、②はその遠心後上清を移すときに用いる。
さて、準備が整ったらいよいよ検査開始です。
まずはサツマイモの検査したい部位(イモ本体やつるの一部)からDNAを抽出します。
A-2. カミソリを使って検体の植物から0.2 x 1 cmを切り出し(厚さ0.1 ~ 0.2 cm)、①に入れます(サンプルが複数ある場合は、その都度、手袋・カミソリを交換します)。
ここで注意したいのは、検体同士が混ざらないようにすることです(コンタミネーションの防止)。
このキットの原理は、検体に微量に含まれるDiaporthe destruens(旧名Plenodomus destruens)の特定DNA領域をLAMP法で増幅し、目で見て分かる蛍光発色に変換するという方式です。
例えば切り出すカミソリを使い回すと、別の検体にもDiaporthe destruens(旧名Plenodomus destruens)のDNAが混入して、本来感染していない検体が陽性反応を示してしまう(偽陽性)ことに繋がってしまいます。そのため、カミソリや手袋は検体ごとに交換するようにしましょう。
また検体を切り出すときは、下にアルミホイルもしくはラップなどを敷き、1検体使用するごとに破棄することをお勧めします。

図7:検体を切り出す環境の一例。工作板があれば切り出すサイズが分かりやすい。

図8:つるで検査を行う場合は、地際部(土壌からの生え際)を使用する(写真は種芋から伸びたつる)。
切り出した検体は、事前に準備した①のチューブ(図6)に、中の溶液が跳ねないよう入れてください。
A-3. チューブ内の植物体をペッスルで磨砕し、16,200 x gで5分間常温にて遠心します。
A-4. 上清15 μLを回収し、②に加えた後、ボルテックスミキサーにて数秒間撹拌し、スピンダウンします。
A-5. 1 μLをLAMP反応の「DNAサンプル」として使用します。
ペッスルで十分すりつぶしてください。つるの場合は繊維質で少しすりつぶしにくいかも知れませんが、繊維質以外の部分が十分破砕されていれば問題ありません。こちらも検体ごとにペッスルを交換します。
*NaOHが目に入らないよう、ゴーグルをするなど十分注意してください
遠心分離機で処理した後、上清15 μLを準備しておいたTris-HClに移します。
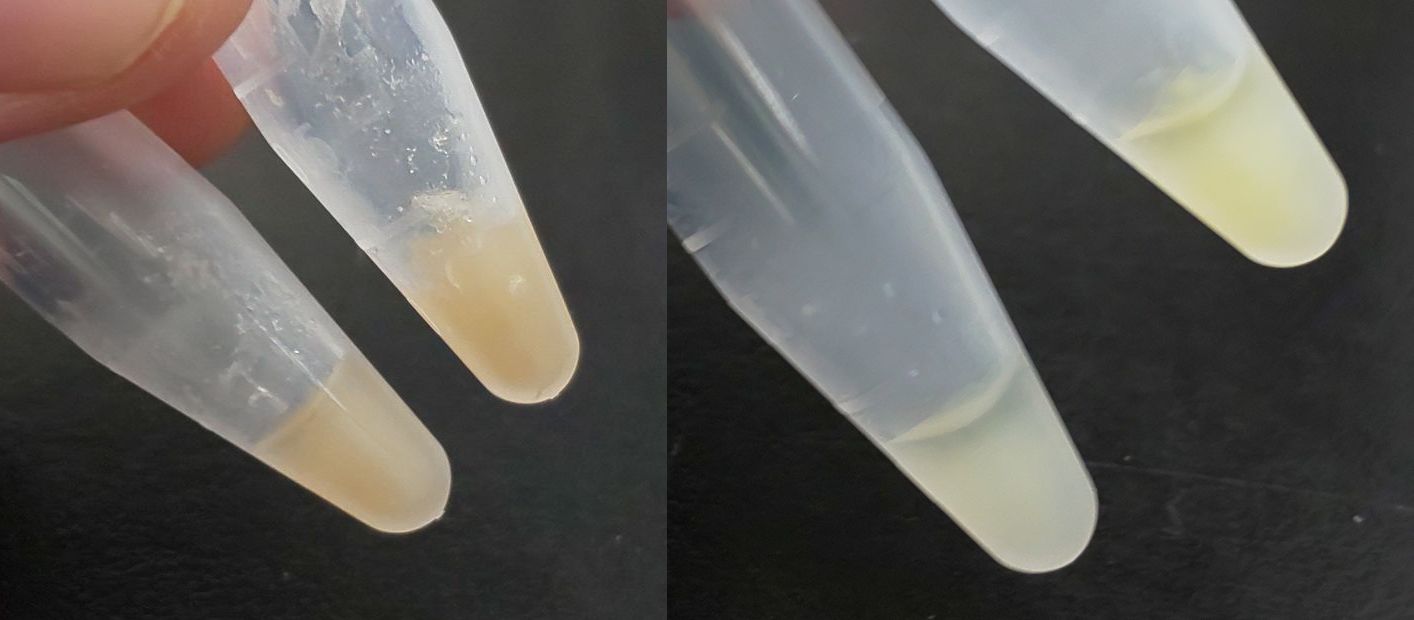
図9:切り出した塊根を磨砕したもの(左)と、遠心したもの(右)。沈殿物の割合が大きいため、遠心で分離させる。
これでDNA抽出工程が終わりましたので、使用するまで一旦静置しておきます。
3. 陽性コントロールの調製(工程B)
陽性コントロールは乾燥化された状態で付属しています。検査で使用するために、専用の溶解液で溶かす工程になります。
B-1. Pd陽性コントロールを取り出します。
※チューブを取り出した後、試薬の吸湿を避けるため、残りの試薬は直ちに元のアルミパックで密封してください。
B-2. 上記チューブにPd陽性コントロール溶解液10 μLを添加した後、スピンダウンします。
※乾燥化されたPd陽性コントロールはチューブの底部に付着(赤色試薬)しているため、Pd陽性コントロール溶解液と確実に接触させてください。
B-3. 室温で5分間、静置します。
B-4. タッピングあるいはボルテックスした後、スピンダウンし、「Pd陽性コントロール溶液」とします。
Pd陽性コントロールは乾燥状態を保つため、アルミパックに入っています。
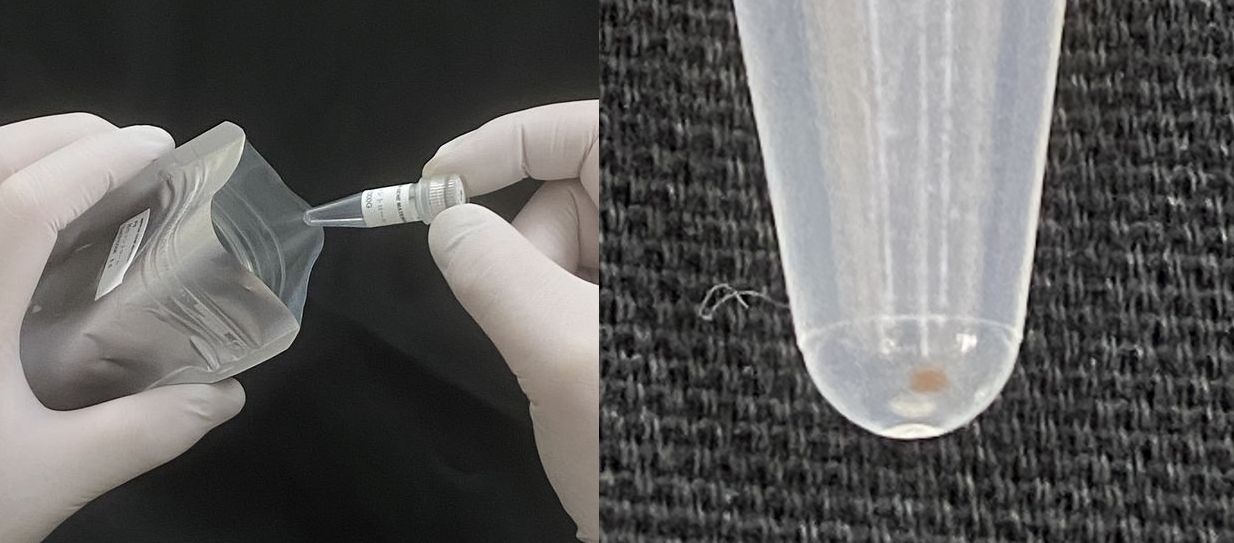
図10:陽性コントロールの取り出し(左)。乾燥化されたものがチューブの底に付着しているので、専用の溶解液を加えて溶解させる(右)。
コントロール溶解液を加えた後、室温で5分間静置してください。これでPd陽性コントロール溶液の完成です。
4. LAMP反応(工程C)
DNAサンプルと陰性コントロール、陽性コントロールの準備が整いましたので、LAMP反応によってDNAを増幅させる工程に入ります。まずは検査溶液の準備からです。
C-1. ピンセットを用いてPd検出用乾燥試薬を必要本数(検体数+コントロール数)取り出します。
※チューブ上方に乾燥試薬が付着していた場合には、チューブを軽く振って乾燥試薬をチューブ底に落としてから、アルミブロックあるいはプレートラックに立て、氷上に静置します。
※試薬の吸湿を避けるため、残りの試薬は直ちに元のアルミパックで密封してください。
C-2. Pd試薬溶解液、ミネラルオイルを取り出します。チューブをタッピングあるいはボルテックスミキサーにて1秒間 x 3回の撹拌により混合し均一にした後、スピンダウンを行います。
検査溶液の作製
C-3. Pd検出用乾燥試薬のキャップを開け、Pd試薬溶解液24.0 μLを添加して、キャップを閉じます。2分間静置して、乾燥試薬を溶解させます。これを検査溶液とし、氷上に静置しておきます。
※乾燥試薬を試薬溶解液の間に気泡が見られる場合には、スピンダウンにより気泡を除去し、乾燥試薬と試薬溶解液が確実に触れる様にしてください。
Pd検出用乾燥試薬もPd陽性コントロールと同様、アルミパックに入っています。

図11:乾燥試薬が入ったアルミパック(左)と、中に入っているチューブ(右)。
乾燥試薬が入っているPCRチューブは8本分のチューブが繋がっていますので、必要数に応じてはさみで連結を切り離してご使用ください。
また、忘れずに検体番号を書いておきましょう。PCRチューブの蓋の部分(チューブ上部)だけに番号を書いていた場合、油性ペンの文字が消える場合がありますので、チューブの側面にも同じ内容を書いておくとより安心です。
専用の溶解液で溶解させれば、検査溶液の準備完了です。
C-4. 陰性コントロール用チューブにPd陰性コントロール溶液を1.0 μL添加してキャップを閉じます。次に、サンプル反応用チューブにDNAサンプルを1.0 μL添加してキャップを閉じ、最後に、陽性コントロール用チューブにPd陽性コントロール溶液を1.0 μL添加してキャップを閉じます。
※蒸発による検査溶液の濃縮が起こると検査反応の効率が著しく低下しますので、必要に応じてミネラルオイルを20.0 μL添加してください。インキュベーター(恒温器)として、ホットボンネット機能を有するサーマルサイクラーを使用する場合には、ミネラルオイルの添加は不要です。
※ミネラルオイルを添加する場合、必ず乾燥試薬の溶解を確認した後に実施してください。溶解前の乾燥試薬にミネラルオイルが触れた場合、乾燥試薬が不溶化することがあります。
準備が整いましたので、DNAサンプルとコントロールを添加していきます。コンタミを避けるため、蓋の開け閉めは1本ずつ行いましょう。
保温中に溶液が蒸発するのを防ぐため、ミネラルオイルを重層します。もし保温するのにホットボンネット機能付のサーマルサイクラーを用いる場合は、ミネラルオイル添加は不要です。

図12:ホットボンネット機能付サーマルサイクラーの例。
C-5. 全てのキャップを閉じた状態で転倒混和して均一にした後、スピンダウンを行い、インキュベーター(恒温器)を用いて65℃で40分間、保温します。
※混合の際は気泡が発生しないよう、ボルテックスミキサーによる撹拌は行わないでください。
C-6. 80℃で2分間の加熱処理により、検査反応を停止させます。
DNAを増幅させるときによく用いられるPCR法では、温度の上下を正確に繰り返すためのサーマルサイクラーが必要なのですが、LAMP法は等温反応のため、温度計と鍋とガスコンロ(あるいはポットや電気ケトル)があれば十分なので、高額な初期投資をしなくても検査環境を作ることができる点がメリットです。魔法ビン(口の広いスープジャーが使いやすいと思います)でも温度を一定に保つことができますので、工夫すれば検体のある現場の近くで検査を行うことも可能です。

図13:鍋を使って保温する場合(左)とスープジャーを使用する場合(右)の例。
最後に、結果の判定です。
まず陽性コントロールと陰性コントロールをチェックし、陽性コントロールのチューブは黄緑色に変化し、陰性コントロールのチューブは淡い赤色のままであることを確認しましょう。この2つのコントロールがちゃんと想定通りの結果になっているかどうかが、検査が成功したか失敗したかの判断ポイントになります。
特別な検出装置がなくても目視で判定できる点がこのキットの長所の1つになります。
もしUVを照射できる装置があるようでしたら、そちらを使用すると結果がより分かりやすくなります。

図14:検査結果を目視で見た場合(上)と、UV照射装置としてトランスイルミネーターを使用した場合(下)の例。陽性の場合は黄緑色に変化。
検査終了後ですが、LAMP反応は多くのDNA産物を複製しますので、エアロゾル化して環境を汚染することを防ぐためにも検査が終わったらオートクレーブ(高圧蒸気滅菌)にはかけずにビニール袋などに密閉して、お住いの自治体が定める方法に従って捨ててください。
5. おわりに
今回はサツマイモ基腐病検出キットの使い方についてご説明いたしました。キット価格は決して安くはありませんが、その分操作が簡便であり、検査環境もそれほど高額な設備投資が必要ではないということが伝わればと思います。キット使用のより具体的なイメージを持っていただく事で、導入をご検討されておられる方の参考になれば幸いです。
関連製品・関連記事は以下をご覧ください。
・【期間限定キャンペーン】サツマイモ基腐病検査サービスのお知らせ
・サツマイモ基腐病の拡大について
・日本における植物病の防疫について
・検査キット:サツマイモ
【外部リンク】
・DryADD™サツマイモ基腐病検出LAMPキット(ニッポンジーンマテリアル)











